셀트리온, 美 FDA에 유플라이마-휴미라 상호교환 변경허가 신청
상호교환성 글로벌 3상서 동등성·안전성 입증
“세계 최대 시장 美서 가파른 점유율 확대 기대”
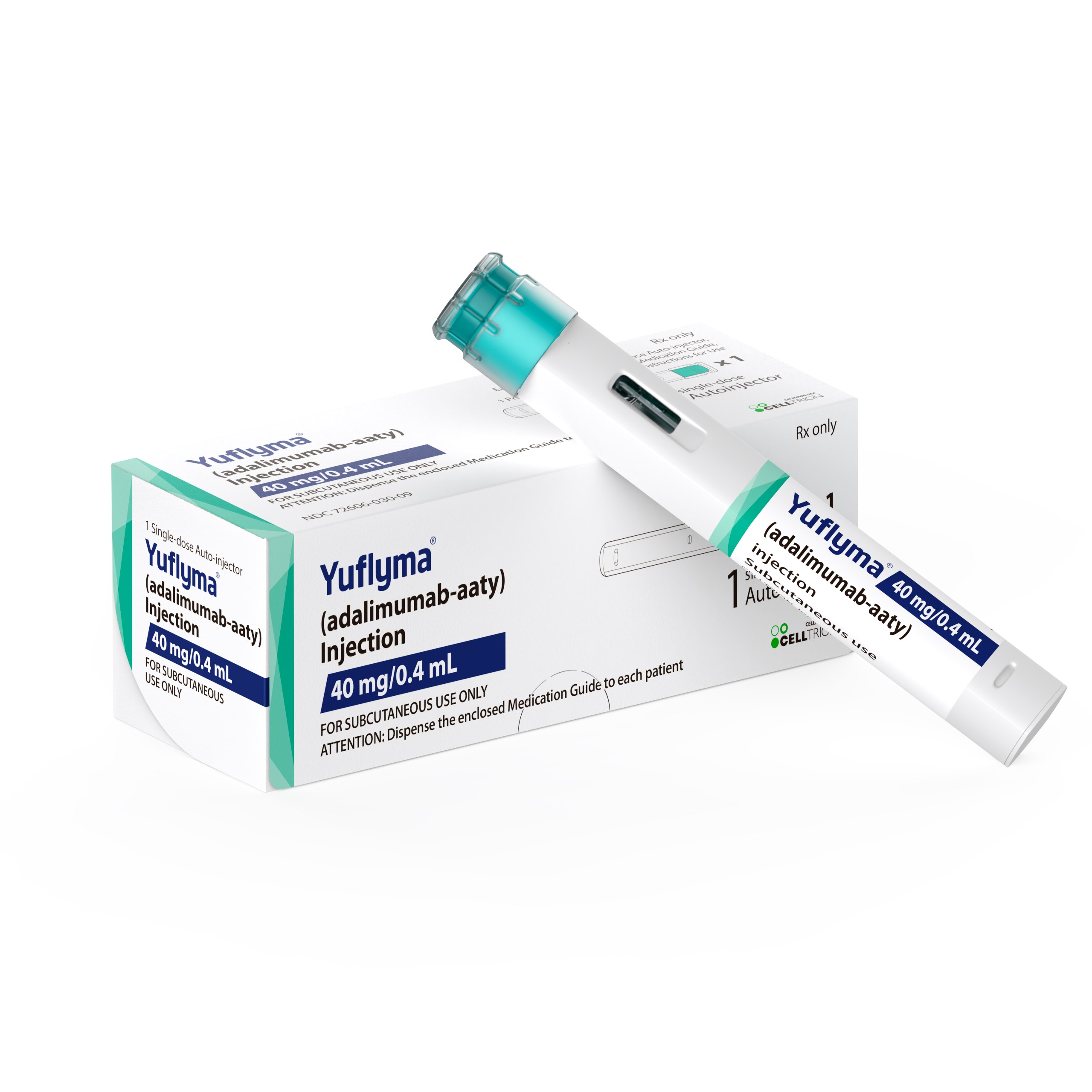
셀트리온 자가면역질환 치료제 ‘유플라이마’. [사진=셀트리온]
[서울경제TV=황혜윤 인턴기자]셀트리온은 자가면역질환 치료제 ‘CT-P17(유플라이마)’과 오리지널 의약품인 ‘휴미라’ 간 상호교환성 확보를 위한 변경허가 신청서를 미국 식품의약국(FDA)에 제출했다고 10일 밝혔다.
셀트리온은 유플라이마와 휴미라의 상호교환성 허가 획득을 위해 글로벌 임상 3상을 진행하고 FDA에 변경허가를 신청했다. 글로벌 임상은 중등도 내지 중증 판상형 건선 환자 367명을 대상으로 진행했다. 이를 통해 유플라이마와 휴미라 간 다회교차 투약군과 휴미라 유지 투약군 간의 통계적 동등성 및 안전성을 입증했다는 설명이다.
셀트리온은 유플라이마와 휴미라의 상호교환성의 인정이 유플라이마의 미국 시장 점유율 확대에 긍정적 영향을 미칠 것으로 기대하고 있다. 상호교환 지위를 확보하면 의사 개입 없이도 약국에서 유플라이마를 휴미라 대신 환자에게 줄 수 있기 때문이다.
유플라이마는 최초의 고농도 휴미라 바이오시밀러다. 저농도 대비 약물 투여량을 절반으로 줄이고 통증을 유발할 수 있는 시트르산염(구연산염)을 제거한 것이 특징이다. 셀트리온은 유럽의약품청(EMA) 및 FDA로부터 류마티스 관절염(RA), 염증성 장질환(IBD), 건선(PsO) 등 적응증에 대해 유플라이마의 판매 허가를 획득하고, 공급을 진행 중이다.
유플라이마의 오리지널 의약품인 휴미라는 블록버스터 자가면역질환 치료제다. 2022년 기준 약 212억3,700만 달러(약 27조6,000억 원)의 매출을 기록했다.
셀트리온 관계자는 “미국 내 유플라이마와 휴미라 간 상호교환성 확보를 위한 변경허가가 완료되면, 바이오시밀러 확대에 우호적인 분위기가 형성되고 있는 세계 최대 시장인 미국에서 더욱 가파른 점유율 확대를 기대할 수 있다”며 “상호교환 지위 확보를 위해 최선을 다하겠다”고 말했다. /mohyeyun@sedaily.com
[ⓒ 서울경제TV(www.sentv.co.kr), 무단 전재 및 재배포 금지]